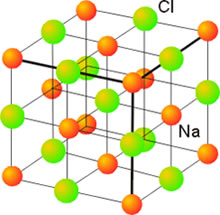
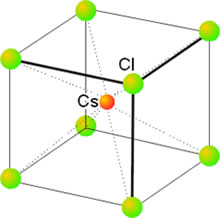
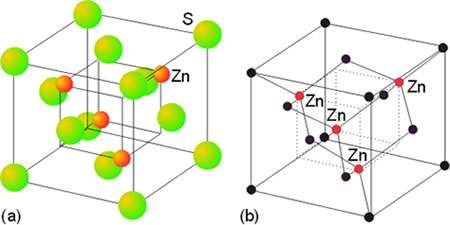
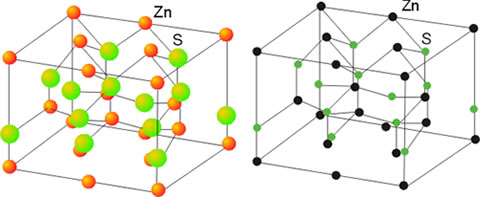
Características de los sólidos cristalinos
En el estado sólido, las moléculas, átomos o iones que componen la sustancia considerada están unidas entre sí por fuerzas relativamente intensas, formando un todo compacto. La mayor proximidad entre sus partículas constituyentes es una característica de los sólidos y permite que entren en juego las fuerzas de enlace que ordenan el conjunto, dando lugar a una red cristalina. En ella las partículas ocupan posiciones definidas y sus movimientos se limitan a vibraciones en torno a los vértices de la red en donde se hallan situadas. Por esta razón las sustancias sólidas poseen forma y volumen propios.
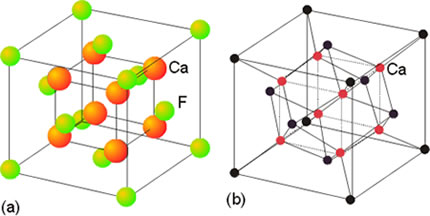
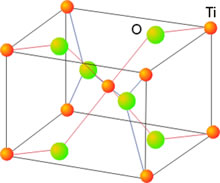
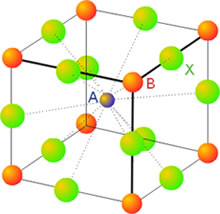
La mayor parte de los sólidos presentes en la naturaleza son cristalinos aun cuando en ocasiones esa estructura ordenada no se refleje en una forma geométrico regular apreciable a simple vista. Ello es debido a que con frecuencia están formados por un conjunto de pequeños cristales orientados de diferentes maneras, en una estructura policristalina. Los componentes elementales de una red cristalina pueden ser átomos, moléculas o iones, de ahí que no se pueda hablar en general de la molécula de un cristal, sino más bien de un retículo elemental o celdilla unidad, que se repite una y otra vez en una estructura periódica o red cristalina.
Las propiedades físicas de los sólidos, tales como temperatura de fusión, capacidad para conducir la corriente, resistencia a la deformación, dureza, etc., dependen de las características de las fuerzas de enlace que unen las entidades elementales. Así, los sólidos iónicos, como las sales, son duros y a la vez frágiles, con puntos de fusión altos. Aunque son malos conductores de la electricidad sus disoluciones, sin embargo, presentan una conductividad elevada. Los sólidos formados por moléculas apolares, como el Cl2, el H2 o el CO2, son blandos como corresponde a la debilidad de las fuerzas de interacción entre ellas (fuerzas de Van der Waals). Presentan un punto de fusión bajo lo que indica que sólo a bajas temperaturas, las débiles fuerzas ordenadores del enlace pueden predominar sobre el efecto disgregador del calor. Su conductividad eléctrica es extremadamente baja como corresponde a la ausencia de cargas libres.
Los sólidos formados por moléculas polares, como el agua, presentan características intermedias entre ambos tipos de sólidos, los iónicos y los apolares. Las características del enlace metálico con un gas de electrones externos compartidos hace que los sólidos metálicos sean buenos conductores de la electricidad y del calor, y dúctiles y maleables, aunque con elevados puntos de fusión. Un tipo de sólido de propiedades extremas lo constituyen los sólidos covalentes; están formados por una red tridimensional de enlaces atómicos fuertes que dan lugar a propiedades tales como elevados puntos de fusión, escasa conductividad y extraordinaria dureza. El diamante, que es carbono puro cristalizado, constituye un ejemplo de este tipo de sólidos.
Teoría de bandas en los sólidos
Todos los sólidos cristalinos presentan una estructura periódica, por lo que un electrón genérico que se viese sometido a la influencia de la red cristalina poseería una energía potencial que variaría también de una forma periódica en las tres direcciones del espacio. Esta situación se traduce, de acuerdo con la mecánica cuántica, en que cada uno de los niveles de energía que correspondería a un átomo aislado se desdobla tanto más cuanto mayor es el número N de átomos constitutivos de la red, dando lugar a una serie de niveles prácticamente contiguos que en conjunto constituyen una banda de energía.
El número máximo de electrones que pueden ocupar una banda determinada viene limitado por el principio de exclusión de Pauli que indica que en cada nivel atómico se pueden acomodar, a lo más, dos electrones y siempre que sus espines respectivos sean opuestos; por tal motivo en una cualquiera de las bandas correspondientes a una red cristalina formada por N átomos iguales, podrán acomodarse como máximo 2N electrones.
Las bandas de energía en un sólido cristalino desempeñan el mismo papel que los niveles electrónicos de un átomo aislado e incluso se representan de la misma manera mediante las letras s, p, d, f, etc.; por tanto, la energía de un electrón en un sólido sólo puede tomar valores comprendidos en alguna de las múltiples bandas de energía del sólido.
En algunos tipos de sólidos las bandas pueden solaparse y en otros, sin embargo, los correspondientes diagramas de energía aparecen separados por espacios intermedios que representan valores de la energía que no pueden poseer los electrones; por ello se les denomina bandas prohibidas.
La teoría de bandas permite explicar con una excelente aproximación el fenómeno de la conducción eléctrica en los sólidos. En algunos sólidos, la última banda no está ocupada completamente, lo que permite a los electrones de esa banda ganar energía por la acción de un campo eléctrico externo y desplazarse por la red.
La mayor parte de los metales presentan, no obstante, bandas superiores incompletas que se superponen entre sí permitiendo, asimismo, la movilidad de los electrones que son excitados por un campo eléctrico. Este movimiento de cargas en el seno de la red cristalina constituye una corriente eléctrica.
Una gran mayoría tanto de sólidos iónicos como de covalentes, son malos conductores de la electricidad (aisladores). En ellos la banda más alta conteniendo electrones (banda de valencia) está completamente llena.
Ello supone, de acuerdo con el principio de exclusión de Pauli, que los electrones no pueden ganar energía y saltar de un nivel a otro dentro de la banda, lo que equivale a restringir su movilidad al entorno de su núcleo atómico.
Además la siguiente banda vacía (banda de conducción) está lo suficientemente separada de aquélla como para que la banda prohibida no pueda ser salvada por la acción de un campo eléctrico ordinario. Tal circunstancia explica su reducida conductividad eléctrica.
Existen algunos sólidos como el silicio y el germanio que tienen una estructura de bandas semejante a la de los aisladores. Sin embargo, en ellos la banda prohibida que separa la de valencia, completamente llena, y la de conducción, completamente vacía, es estrecha, de modo que es posible excitar los electrones más altos de la banda de valencia y transferidos a la de conducción.
En tal caso se puede hablar tanto de una conducción por los electrones de la banda superior, como de conducción por los huecos que se generan en la banda inferior y que se comportan como cargas positivas. Se trata de sólidos semiconductores. El hecho de que su banda prohibida sea estrecha permite bombear electrones a la banda de conducción sin más que elevar suficientemente la temperatura.
Los semiconductores constituyen los materiales sólidos clave en la fabricación de dispositivos electrónicos. Sus propiedades, mejoradas y aprovechadas gracias a la investigación básica y aplicada, no sólo han constituido un elemento clave en el desarrollo de la informática, la instrumentación científica de alto nivel y las telecomunicaciones, sino también en el diseño de aparatos electrodomésticos y de uso habitual.
Mario Pedraza
Electrónica del Estado Sólido Sección 2